Sulfation of glucuronic acid in the linkage tetrasaccharide by HNK-1 sulfotransferase is an inhibitory signal for the expression of a chondroitin sulfate chain on thrombomodulin
Biochem.
Biophys. Res. Commun. 415(1), 109-113 (2011)
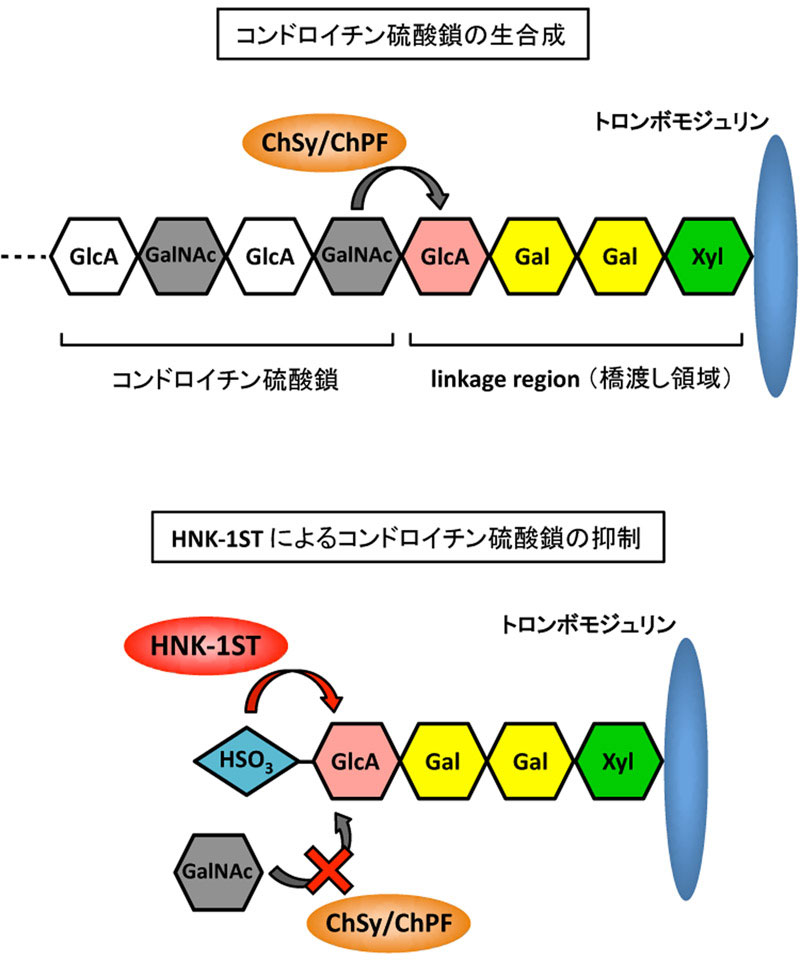
トロンボモジュリンは血管内皮細胞の細胞膜上に発現するプロテオグリカンで、抗凝固性因子として重要な役割を果たしています。トロンボモジュリンにはコンドロイチン硫酸鎖をもつプロテオグリカン型と非プロテオグリカン型が存在するため、パートタイムプロテオグリカンと呼ばれています。これまで、コンドロイチン硫酸鎖をもつトロンボモジュリンの方が高い抗凝固活性を示すことは知られていましたが、コンドロイチン硫酸鎖修飾の有無がどのようにして決定されるのかについては未解明でした。今回私達は、コンドロイチン硫酸鎖が結合する橋渡し領域四糖構造(GlcA-Gal-Gal-Xyl)の末端グルクロン酸が硫酸基転移酵素HNK-1STによって硫酸化されることで、コンドロイチン硫酸鎖の付加が抑制され、抗凝固活性が有意に低下することを明らかにしました。また、HNK-1STの作用によって生じた硫酸化糖鎖はHNK-1抗体によって認識されることから、ヒト尿中の非プロテオグリカン型トロンボモジュリン上に存在する硫酸化四糖(HSO3-GlcA-Gal-Gal-Xyl)と同一のものであると考えられます。またこの硫酸化四糖をもつトロンボモジュリンはコンドロイチン硫酸鎖生合成酵素(ChSy/ChPF)の基質とならなかったことから、橋渡し構造の硫酸化はコンドロイチン硫酸鎖生合成において阻害的に働くことが示されました。これらの結果から、HNK-1STがパートタイムプロテオグリカンの生合成機構における重要な分子であることが明らかとなりました(図)。